
为规范结题临床试验项目资料的归档管理,确保资料完整性、可追溯性,特制定以下流程,申办者 / CRO 需严格遵照执行:
一、前期资料准备与伦理结题审批
1、资料整理:申办者 / CRO 依据《临床试验归档目录》(详见附件 1:91短视频 药物临床试验资料归档清单、附件 2:91短视频 药物临床试验资料归档清单(Ⅰ 期临床专业用)、附件 3:91短视频 医疗器械临床试验资料归档清单),系统整理项目全周期资料,确保无遗漏、无破损。
2、伦理结题审批:申办者 / CRO 向本中心伦理委员会提交项目结题报告,经伦理委员会审查通过后,获取伦理结题批件。
3、小结表 / 总结报告盖章:待伦理结题审查完成且确认通过后,机构办可为申办者 / CRO 提供的分中心小结表或总结报告加盖公章,盖章前需核对文件版本与内容一致性。
二、归档预约与资料清点
1、预约存档时间:申办者 / CRO 需提前与机构资料管理员沟通,确认资料存档的具体时间,避免现场等待或延误。
2、受控表格处理:
(1)申办者 / CRO 对项目资料中的 “文件受控表格” 进行逐一清点,形成清点清单;
(2)清单需经对应专业组负责人确认签字;
(3)将确认后的受控表格(含清单)全部递交机构办,由机构办完成登记备案,同时按规定流程销毁无需留存的冗余表格(销毁记录需归档)。
三、资料规范化整理要求
1、整体整理原则:所有归档文件需严格按照附件 1-3 的目录顺序整理,确保逻辑清晰;EDC(电子数据采集系统)数据需刻录光盘,刻录后需测试光盘可读性(确保数据可正常打开、无损坏),并在光盘表面标注项目名称、项目编号及刻录日期。
2、专项资料整理细则:
(1)研究者文件夹
(2)受试者资料文件盒
(3)标签统一规范
1)文件夹规格:使用厚度为 55mm 的黑色文件夹(样式参考图 1);
2)隔页纸要求:根据纸质版文件目录清单,选择对应的隔页纸,并在隔页纸上标注相应序号(序号规则参考图 2);
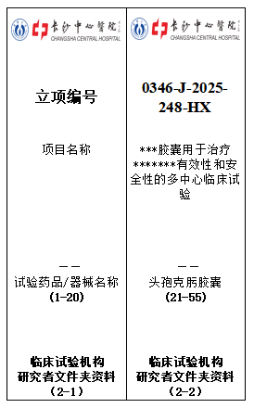
3)侧标签填写:按照《研究者文件夹归档侧标签模板》(附件 4:研究者文件夹归档侧标签模板(黑色 55mm))完整填写信息,包括项目名称、项目编号、申办者名称等,确保信息准确无误。
4)文件盒规格:使用蓝色 A4 尺寸、厚度 55mm 的文件盒(样式参考图 3);
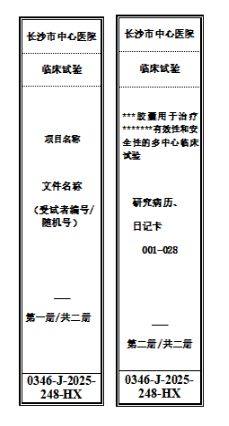
5)侧标签填写:按照《受试者资料盒侧标签模板》(附件 5:受试者资料盒侧标签模板(蓝色 55mm))完整填写信息,标注项目名称、受试者编号范围等;
6)资料摆放:受试者病例需按受试者编号顺序依次摆放,其他关联资料(如知情同意书原件、检查报告等)需分类整理后随病例归档;若项目组已将受试者资料单独装订成文件夹,可直接按文件夹单元归档(需在文件夹封面标注受试者编号)。
7)研究者文件夹(黑色)及受试者资料文件盒(蓝色)的侧标签,均需使用试验药品或器械名称的标准简写(避免歧义);
8)标签字体、格式需严格遵循附件 4、附件 5 的模板要求,原则上不得自行修改字体样式、大小或颜色。
四、资料交接与后续更新
1、资料存档与交接:申办者 / CRO 与机构资料管理员共同将整理完成的资料(含纸质资料、EDC 数据光盘)存入机构资料室,双方需共同核对资料数量与完整性,核对无误后填写《资料归档交接记录本》,双方签字确认,完成归档流程(交接记录本由机构办留存归档)。
2、后续资料更新管理:若资料存档后需补充更新资料(如修订版 eCRF、补充总结报告等),申办者 / CRO 需在获取更新资料后及时转交机构资料管理员,具体要求如下:
(1)电子类更新资料(如 eCRF)需刻录光盘,确保光盘可读,并在光盘标注 “项目名称 + 项目编号 + 更新内容 + 更新日期”;
(2)纸质类更新资料由机构资料管理员在归档清单中注明更新内容,确保资料追溯性。
五、图表说明
1、图 1:研究者文件夹(55mm 黑色)样式示例

2、图 2:隔页纸序号标注示例

3、图 3:受试者资料文件盒(A4-55mm 蓝色)样式示例

4、图 4:黑色研究者文件夹侧标签填写示例
5、图 5:蓝色受试者资料盒侧标签填写示例
六、附件清单
2、附件2:91短视频 药物临床试验资料归档清单(Ⅰ 期临床专业用)
(点击附件可下载)

医德医风和医药领域腐败问题集中整治举报:
一、信息平台:91短视频
官网
二、邮寄地址:长沙市韶山南路161号91短视频
安全办,邮编:410004
三、来访接待:91短视频
安全办办公室